中国仿制药市场竞争加剧:品种同质化与生产挑战
近年来,中国的仿制药行业在“带量采购”政策的推动下,优质优价的仿制药加速进入临床并实现经济性替代。然而,随着“国谈”中生物药占比的增加,医保政策的调整也为生物类似药的市场准入提供了便利。这一双重趋势使得中国仿制药市场竞争日益激烈。
根据中国医学科学院药物研究所等机构近日发布的《中国仿制药发展报告(2025)》,中国仿制药市场规模多年维持在9000亿元水平,而企业和品种数量的增加进一步加剧了市场竞争。报告指出,在化学仿制药领域,2024年通过一致性评价或视同过评的品种数较三年前增加了超过三分之二。
仿制药市场的挑战与机遇
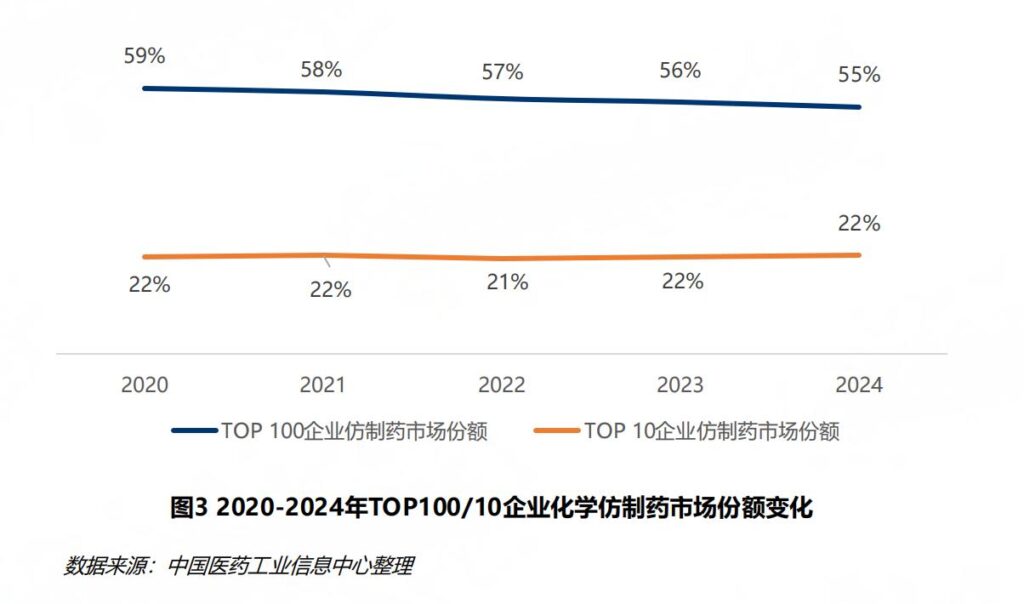
尽管仿制药的研发水平和一致性评价通过率显著提升,但市场仍面临“品种同质化”和“生产拼成本”的困境。报告显示,2024年,化学仿制药市场中Top10企业的市场份额合计仅为22%,市场集中度仍然偏低。
“品种同质化加剧成为仿制药市场竞争的底色。”
在生物类似药领域,截至2024年,中国已有41家制药企业的87款生物类似药获批上市,但仅涉及23个药品通用名。抗体类似药占比超50%,其中包括贝伐珠单抗和阿达木单抗等。
政策推动与市场反应
国务院在2015年提出的《关于改革药品医疗器械审评审批制度的意见》中,将提高仿制药质量列为重要目标之一。这一政策推动了仿制药品通过质量和疗效一致性评价的进程。然而,市场集中度较低的问题仍然存在,许多仿制药尚未通过这一“底线门槛”。
报告指出,2024年过评/视同过评的仿制药品种数达914个,相较2021年的543个大幅增加。然而,70%的过评品种集中在33%的企业,显示出市场竞争的激烈程度。
集采政策的影响
截至今年,国家医保局已开展了十一批国家组织药品集采工作。报告显示,第十批集采中选产品中31%是委托企业生产,相较第二批的3%,集采中B证企业参与程度大幅提高。
“B证企业在集采中显著增多,反映出政策引导、生存压力与行业洗牌的多重作用。”
为了在集采市场上形成竞争优势,仿制药企需要通过规模化生产降低成本,确保中选药品“降价不降质”。对于小型仿制药企而言,他们可以通过较低的报价在集采中获得一席之地,但需要委托生产。
监管与未来展望
近年来,国家药监局多次重申对集采中选产品实行生产企业检查和中选品种抽检的全覆盖,以保障产品合规。2024年和2025年的公告中,监管重心向持C证企业延伸,强调加强委托生产监管。
国家药监局局长李利强调,加强委托生产监管,督促持有人建立覆盖药品生产全过程的质量管理体系,并实现跨区域监管信息共享。
随着仿制药市场的不断发展,如何在竞争激烈的环境中保持创新与质量,将成为企业面临的长期挑战。未来,政策的持续调整和监管的加强将继续影响仿制药市场的走向。






