科学家揭示OSTα/β蛋白新机制,助力理解胆汁酸转运

记者从中国科学院物理研究所获悉,由该所科研人员组成的联合研究团队首次重构出名为OSTα/β的有机溶质转运蛋白的高分辨率冷冻电镜结构,揭示了该蛋白的新颖组装方式及转运机制。相关成果已于1月29日发表在国际学术期刊《自然》上。
在人体消化脂肪的过程中,OSTα/β功能异常会导致消化不良、胆汁淤积及肝损伤等疾病。尽管OSTα/β在调节激素、应对压力和脂代谢中发挥关键作用,但科研人员长期以来对其组装方式知之甚少,主要原因是缺乏对该转运蛋白精细结构和构象变化的直观认识。
OSTα/β的结构与功能
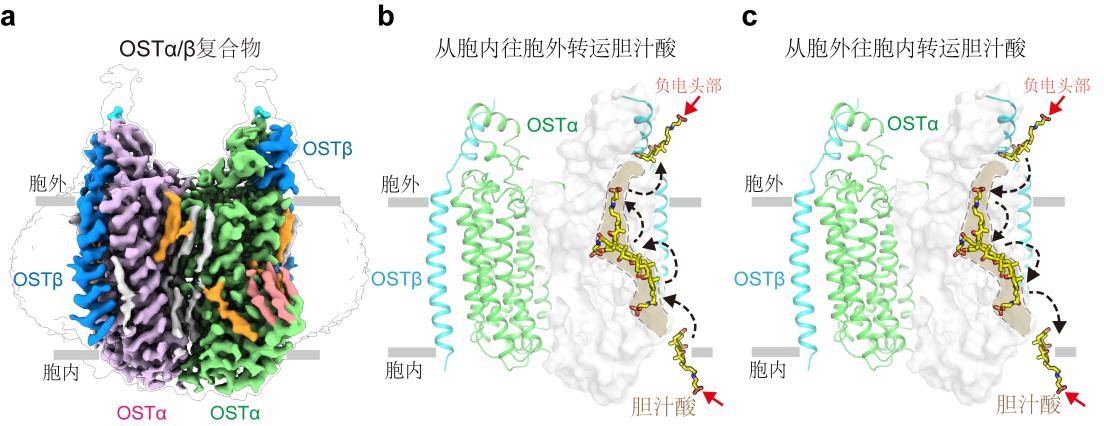
研究发现,OSTα/β由两个OSTα与两个OSTβ亚基组成,各亚基之间的相互作用紧密,保证了OSTα/β的稳定性。此外,研究揭示了OSTα/β中胆汁酸的结合口袋:该口袋内的正电残基与胆汁酸带负电基团相互吸引,从而促进胆汁酸的结合和转运。
“OSTα/β的结构研究为理解胆汁酸的跨膜运输提供了全新的结构框架。”——研究团队负责人
结合分子动力学模拟,研究揭示胆汁酸在转运过程中会经历一个180度的翻转:胆汁酸头部从朝向细胞内侧翻转到细胞外侧,而OSTα/β结构则保持稳定状态。
新型“滑梯”转运模型
基于这些结果,研究人员提出了OSTα/β采用新型“滑梯”转运模型,这一模型不同于传统SLC蛋白的“交替访问”转运模型:该蛋白在底物转运过程中不需要发生大幅度的构象变化,而是利用一个半嵌入膜内的特殊通道,实现胆汁酸从胞内到胞外或者从胞外到胞内的双向转运,转运方向取决于胆汁酸跨细胞膜的浓度梯度。
这一发现解决了长期以来关于OSTα/β组装方式和转运机制不明的根本问题,为理解胆汁酸的跨膜运输提供了全新的结构框架。
科学意义与未来展望
该研究不仅为科学界提供了关于OSTα/β蛋白的新见解,也可能为治疗相关疾病提供新的思路。通过更深入地理解胆汁酸的转运机制,科学家们或许能开发出针对性更强的治疗方法,改善与OSTα/β功能异常相关的健康问题。
未来,研究团队计划继续探索其他相关蛋白的结构和功能,以期揭示更多关于人体内复杂生物过程的奥秘。
(总台央视记者 帅俊全)
更多精彩资讯请在应用市场下载“极目新闻”客户端,未经授权请勿转载,欢迎提供新闻线索,一经采纳即付报酬。