康霈新藥CBL-514治療竇根氏症二期成果登上國際期刊
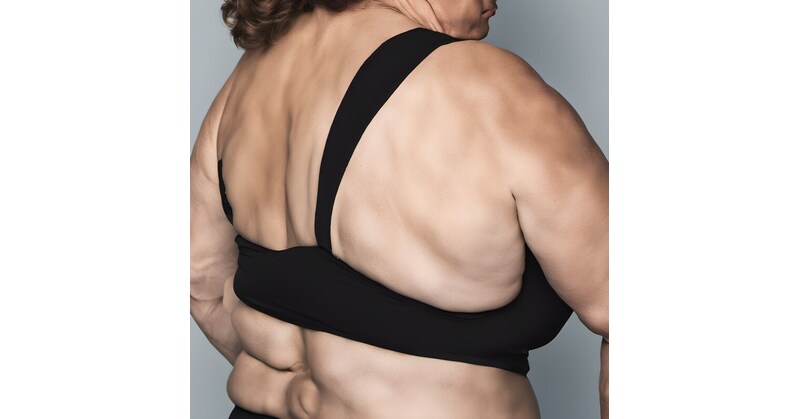
罕病竇根氏症復發性強,患者人數相對多,集中於歐美國家,患者有皮下脂肪堆積的痛性脂肪瘤,目前全球尚無核准治療藥物。 CBL-514 用於竇根氏症的二期研究中展驗顯著療效,具有備受市場期待的潛在臨床應用,有望成為首款核准用於治療竇根氏症的藥物。
康霈生技公司(Caliway Biopharma)旗下的創新減脂藥物CBL-514,針對罕見病竇根氏症(Dercum’s Disease)的二期臨床研究成果,已經在國際權威期刊《美國皮膚科醫學會雜誌JAAD International》上正式發表。這一成就不僅代表著該藥物的臨床價值與研究品質獲得國際學術界的高度肯定,也為竇根氏症患者帶來了新的治療希望。
《JAAD International》是全球皮膚學領域的重要期刊之一,其影響因子達到5.2,收錄標準極為嚴格。CBL-514的研究成果能夠刊登於此,顯示出其在臨床研究設計與結果上的高度醫學價值。
竇根氏症的挑戰與突破
竇根氏症是一種罕見且診斷困難的慢性疾病,患者常在軀幹及四肢出現痛性脂肪瘤,這些脂肪瘤不僅影響外觀,還伴隨著劇烈的疼痛。目前,全球尚無核准的治療藥物,患者只能依賴手術切除、麻醉藥等緩解療法,然而這些方法效果有限且副作用多。
CBL-514在臨床試驗中顯示出顯著的療效,多數患者的脂肪瘤體積縮小超過50%,甚至完全清除,疼痛分數也大幅降低。這一雙重臨床價值使其成為市場期待的潛在治療選項。
臨床試驗的進展與未來
康霈生技的執行長凌玉芳表示,《JAAD International》的刊登再次證明CBL-514在竇根氏症領域的潛力。公司將持續投入資源,期望成為首款獲得核准用於治療竇根氏症的藥物,為全球患者帶來新希望。
目前,CBL-514的Phase 2b臨床試驗已在美國食品藥物管理局(FDA)的批准下完成收案,並正依計畫進行中。這些進展將為後續的臨床開發與全球市場布局提供重要依據。
專家觀點與市場前景
根據專家意見,CBL-514的成功不僅標誌著在罕見病治療上的一大突破,也可能改變目前的治療格局。由於竇根氏症患者多集中於歐美國家,市場潛力巨大。
「CBL-514是目前唯一同時獲得美國FDA孤兒藥資格認定和快速審查資格的藥物,這將有助於加速其臨床開發進程。」
此外,歐盟藥品管理局(EMA)也已授予CBL-514孤兒藥資格認定,這進一步增強了其在全球市場的競爭力。
結語與未來展望
康霈生技的創新藥物CBL-514在竇根氏症治療上的突破性進展,不僅為患者帶來了新的治療選擇,也為全球醫學界提供了新的研究方向。隨著臨床試驗的深入推進,CBL-514有望成為改變竇根氏症治療現狀的關鍵力量。
更多關於竇根氏症及CBL-514的信息,請訪問康霈生技的官方網站。







