Imugene异体CAR-T疗法Azer-cel在DLBCL试验中显现75%总缓解率
(PRNewsfoto/Imugene Ltd)
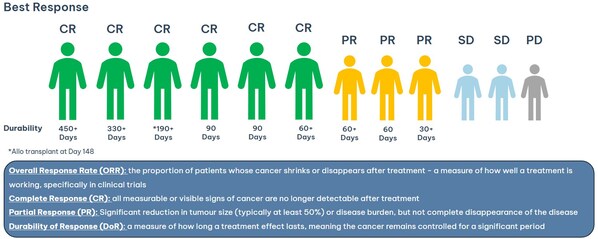
悉尼——临床阶段免疫肿瘤学公司Imugene Limited (ASX: IMU)近日公布,其异体CAR-T疗法azer-cel在治疗复发性/难治性弥漫性大B细胞淋巴瘤(DLBCL)的1b期试验中取得了显著的临床数据。自今年2月发布更新以来,新增5名患者接受治疗,其中2名患者达到完全缓解(CR),3名患者达到部分缓解(PR),总缓解率(ORR)达到75%。
此次试验的结果显示,azer-cel的疗效在多线治疗失败的患者中表现出强大的潜力。首例患者的无癌生存期已达15个月,其他患者则分别保持2个月、5个月和11个月以上的持续缓解。Imugene计划在2025年第四季度与美国FDA讨论azer-cel的关键性/注册临床试验。
背景与试验细节
DLBCL是一种侵袭性非霍奇金淋巴瘤,每年全球新增病例约16万例,其中美国约占3万例。即便采用现有的自体CD19 CAR-T疗法,仍有约60%的患者会复发。azer-cel作为一种即用型异体CAR-T细胞疗法,旨在克服自体CAR-T疗法在地理可及性、生产复杂性和治疗等待时间上的限制。
Imugene的1b期试验在美国和澳大利亚的多个研究中心进行,针对复发性/难治性DLBCL患者,近期扩展至未接受过CAR-T疗法的其他非霍奇金淋巴瘤亚型患者。数据显示,azer-cel联合白细胞介素2 (IL-2)的治疗方案展现出显著的临床活性和持久缓解效果。
专家观点与未来展望
Imugene董事总经理兼首席执行官Leslie Chong表示:“我们对azer-cel试验持续取得的积极数据感到非常欣慰,这些数据进一步验证了该疗法对于多线治疗失败的DLBCL患者的治疗潜力。”
Imugene首席医疗官John Byon博士补充道:“DLBCL是侵袭性最强的淋巴瘤类型之一。尽管现有疗法不断进步,但大量患者仍面临复发或耐药问题。azer-cel为多线治疗后复发的患者带来了重大治疗突破。”
“我们将持续致力于改变难治性血液肿瘤的治疗标准,切实解决这一亟待满足的重大临床需求。”
监管与商业化前景
FDA已授予azer-cel治疗DLBCL的快速通道资格,旨在加速开发并优先审评针对严重威胁生命的疾病且存在未满足临床需求的药物。获得该资质意味着可增加与FDA的沟通频次,并有望获得加速审批和优先审评资格。
Imugene正在积极推进1b期临床试验患者招募工作,目前覆盖美国10个研究中心,并计划在澳大利亚增设至6个研究中心。首例澳大利亚患者已于2025年1月在悉尼皇家阿尔弗雷德王子医院完成给药,并获得完全缓解。
结语
Imugene的azer-cel疗法在DLBCL患者中展现出强大的治疗潜力,尤其是在多线治疗失败的患者中。随着试验的推进和更多数据的公布,azer-cel有望成为DLBCL及其他B细胞淋巴瘤亚型患者的重要治疗选择。Imugene将继续与全球顶尖临床专家合作,推动azer-cel的进一步开发和商业化。






