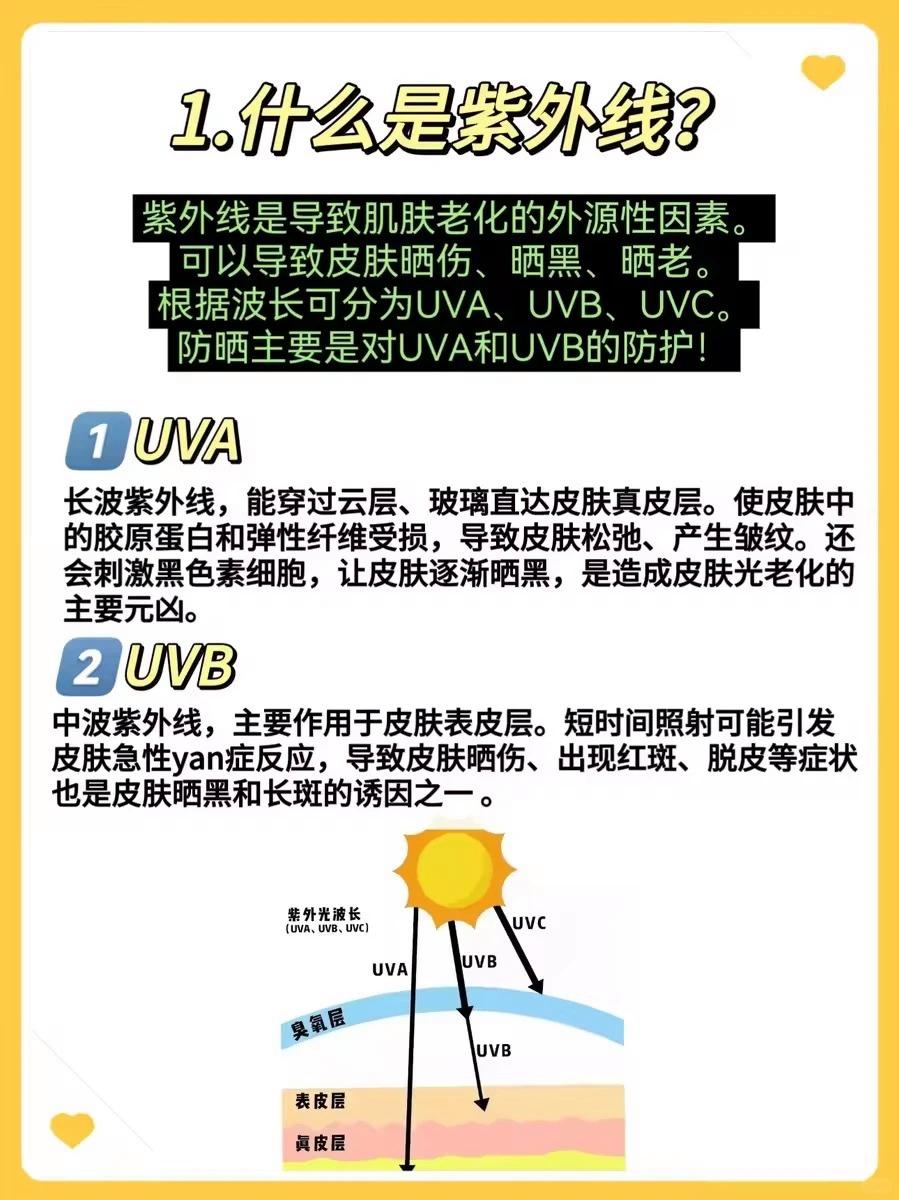
恒瑞医药卡瑞利珠单抗BLA获FDA受理,目标审评日期定于2026年7月

新时空讯:恒瑞医药(01276.HK)于2026年2月2日发布公告,宣布其核心药品注射用卡瑞利珠单抗的生物制品许可申请(BLA)已被美国食品药品监督管理局(FDA)受理。这一进展标志着恒瑞医药在国际市场上的重要一步。
公告指出,此次获受理的BLA涉及注射用卡瑞利珠单抗与甲磺酸阿帕替尼片的联合使用,适用于不可切除或转移性肝细胞癌患者的一线治疗。根据《处方药用户付费法案》(PDUFA),FDA已将该药品的目标审评日期定为2026年7月23日。
突破性临床试验结果
恒瑞医药的这一药物组合在国际多中心III期临床试验中表现出色。试验结果显示,与索拉非尼相比,该组合在一线治疗中显著延长了晚期肝细胞癌患者的无进展生存期和总生存期。中位总生存期最终延长至23.8个月,这是目前该病症一线治疗中最长的OS获益组合,也是首个成功的免疫治疗联合小分子酪氨酸激酶抑制剂的III期试验。
“中位总生存期最终延长至23.8个月,为目前该病症一线治疗最长OS获益组合。”
恒瑞医药的国际化战略
此次BLA的受理是恒瑞医药在全球市场上迈出的重要一步。近年来,公司积极推进国际化战略,力求在全球范围内扩展其药品的市场份额。恒瑞医药的这一战略不仅是为了提升企业的国际影响力,更是为了让更多患者受益于其创新药物。
业内专家指出,恒瑞医药在创新药物研发方面的持续投入,以及与国际知名制药企业的合作,是其成功的重要因素。通过不断的研发投入,恒瑞医药不仅在国内市场占据领先地位,也在国际市场上崭露头角。
展望未来
随着卡瑞利珠单抗BLA的受理,恒瑞医药在肝细胞癌治疗领域的地位有望进一步巩固。专家预计,如果FDA最终批准该药物上市,将为恒瑞医药带来显著的市场收益,并进一步提升其在全球市场的竞争力。
与此同时,恒瑞医药也面临着来自其他国际制药巨头的竞争。未来,公司需要继续加大研发投入,保持技术领先,以应对日益激烈的市场竞争。
新时空声明:本内容为新时空原创内容,复制、转载或以其他任何方式使用本内容,须注明来源“新时空”或“NewTimeSpace”。新时空及授权的第三方信息提供者竭力确保数据准确可靠,但不保证数据绝对正确。本内容仅供参考,不构成任何投资建议,交易风险自担。